NLRP7基因在葡萄胎发生中的作用
摘要:葡萄胎(Hydatidiform Mole,HM) 是一种异常的人类妊娠,以绒毛滋养细胞增生、间质水肿,同时缺乏胚胎发育或者异常的胚胎发育为特征。随着超声的广泛使用,葡萄胎的早期诊断和处理成为可能,但是确诊依据仍然是组织学诊断。葡萄胎的发生机制尚不明确,遗传学方面研究发现葡萄胎的不同的染色体型和错误的基因印记。最近对葡萄胎基因方面研究发现NLRP7 (NACHT,Leucine-rich repeat and PYD containing 7)基因与复发性葡萄胎相关,下面我将对葡萄胎及其与NLRP7基因的最近研究进展做一综述。浙江大学附属第一医院妇科钱建华
关键词:葡萄胎 NLRP7基因
1.葡萄胎概述
葡萄胎(Hydatidiform Mole,HM) 是一种异常的人类妊娠,以绒毛间质水肿、滋养细胞增生同时缺乏胚胎发育或者异常的胚胎发育为特征。葡萄胎最常见的是散发性,而非复发性,在南美葡萄胎的发生率为每1000-1500次妊娠1次,但在拉丁美洲,中东及远东有更高的发生率(1)。我国和东亚地区是葡萄胎的高发区,发生率为北美和欧洲国家的7-10倍,在欧美国家,黄种人葡萄胎的发生率明显高于白种人。葡萄胎患者妊娠结局令人担忧,一次葡萄胎后再患葡萄胎的风险为1-6%(3,4),而再次妊娠不良生育结局者则高达10-20%;二次葡萄胎后再患葡萄胎的风险增为20-30%。此外尚有15-20%的葡萄胎会恶变为妊娠滋养细胞肿瘤,甚至危及患者的生命。
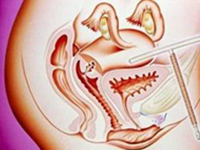
葡萄胎的正真发病原因尚不明确,其发生可能与基因突变、年龄、社会环境等有关。通过细胞遗传学结合病理学研究表明葡萄胎有多种受精形式,形成不同的遗传背景。部分性葡萄胎(Partial hydatidiform mole ,PHM)通常为双精子受精导致的三倍体即有69条染色体,其中带有两组父系染色体和一组母系染色体。完全性葡萄胎(Complete hydatidiform mole, CHM )分为父系来源的完全性葡萄胎(Androgenetic CHM, AnCHM)及双亲来源的完全性葡萄胎(Biparental CHM,BiCHM)(图一)。AnCHM通常为空卵与单精子受精后自身复制(占75%)或空卵与双精子受精(占25%)导致的二倍体,46条染色体均来自父亲,缺乏母亲的染色体。BiCHM亦为二倍体核型, 约占完全性葡萄胎的20%,与AnCHM不同的是仅一套染色体来自父亲,而另一套来自母亲,但却具AnCHM所有经典的组织病理学特征, BiCHM往往表现为家族性聚集及终生不良生育结局,表现为流产、死胎或葡萄胎[1]。
.
(a )大多数CHM未雄性单性生殖(AnCHM),即单个精子与空卵子受精并自我复制;(b)大概20%为双精子与一个空卵子受精;(c)大部分PHM为双精子与正常卵子受精,形成三倍体(d)RHM可为双亲遗传(BiHM)即同时含有父系和母系的染色体基因。
由于葡萄胎临床表型及遗传背景的复杂性,并且从未在动物上发现过葡萄胎,从而通过建立动物模型获悉数据的可能性很小,因此目前的多数葡萄胎发生的分子机制的研究集中在家族性复发性葡萄胎(FRHM,family recurrent hydatidiform moles)。先前的研究表明FRHM隶属常染色体隐性遗传,并且同一FRHM患者与不同的性伴侣婚配皆可再患葡萄胎,所以有学者认为根本的遗传缺陷存母体本身,有些女性可能有纯合或杂合的常染色体隐性遗传基因缺陷,导致卵子或者受精卵发生基因印记异常,从而不能正常的调节胚胎发育[15]。在1999 年Moglabey等首次报道了FRHM染色体双亲来源的遗传背景(即BiCHM类型);并将FRHM的遗传易感基因的侯选区域定位于染色体19q13.3―19q13.4区域,对更多的家系的研究也证实了这一结论, 但该区域是基因富集区, 包含大约60个不同的基因, 并且有的FRHM存在遗传异质性, 至2006年才确定导致部分RHM(recurrent hydatidiform moles)的致病基因为NLRP7基因[2]。
2. NLRP7与葡萄胎的关系
2.1 NLPR7与NLRP家族简介
NLRP家族(又称NALP ,NLR family, pyrin domain containing )是最近才发现的一个家族。NALP家族属于一种胞浆组合蛋白,包括三个结构区域,分别是①PYD区域(a pyrin domain)②NACHT区域(a central nucleotide-binding and oligomerization domain)③LRR区域(a ligand binding leucine-rich repeat domain)[4]。
NLRP家族被认为介导激活宿主先天免疫系统对细菌及其分泌产物及其他病原体相关的分子模式(Pathogen-associated molecular patterns,PAMPs)类的物质做出免疫反应。NLRP家族在免疫方面的重要作用与其结构是分不开的:①NACHT区(又被称作NBD或者NOD区),是NLR家族中共同拥有的结构,属于NTPase区超大家族,包括七个不同的基序,其中有ATP/GTP酶特异性P环和Mg2+结合区[5]。NACHT区与凋亡蛋白酶激活因子(APAF-1)的核酸结合区――称为核酸结合的ARC区(NB-ARC)具有同源性。NB-ARC可结合dATP/ATP,使APAF-1产生细胞色素c依赖性的寡聚化从而诱导csapase-9前体的激活。②LRR是一个20-29个残基序列的区域,在许多具有分化功能的蛋白上都有,这是一个拥有与Toll样受体(Toll-like receptors, TLR)胞外段相同的结构域,主要负责探测和识别配体,包括保守的PAMPs(pathogen-associated molecular patterns)和其他配体。③PYD为效应结构,其功能是把NLR受体分子和下游衔接蛋白及效应分子连接起来,例如PYD-PYD相互结合,产生一系列分子反应。
NLRP家族在哺乳动物配子发生的时候就已经存在并确定[6],与哺乳动物胚胎的发育有一定的联系[7,6],Pu Zhang等人的体外胚胎研究发现不同的NLRP家族成员在配子和植入前的不同阶段有不同的量,并且发现异常合子与正常合子NLRP家族成员量的表现不一致[7]。
NLRP7(NACHT, Leucine-rich repeat and PYD containing 7,别名NALP7,PYPAF3,NOD12,PAN7,CLR19.4)基因位于人类常染色体19q13.42上,是NALP家族中14个成员中的一分子,该基因在滋养细胞、睾丸、心脏、肺脏、肝脏等器官上有表达[3]。
2.2 NLRP7基因在葡萄胎患者中的变异
NLRP7基因的变异存在多样性,至今已在不同人种复发性葡萄胎及不良生育结局患者中发现大约50 个NLRP7 基因突变或变异点,包括终止子突变、重排、接合位点突变和错义突变,但在人种匹配的对照组中未发现突变和变异(见INFEVERS, http://fmf.igh.cnrs.fr/ISSAID/infevers/)。(见表一)。
研究显示大多数突变方式为点突变,少数为缺失,重叠,这些突变或变异点以纯和或杂合的形式被发现。研究发现变异出现较多的为LRR区域,说明了LRR的转录变异体在NLRP7上是个危险的区域,影响正常的繁殖功能[13]。NLRP7变异或变异点大多发现在复发性葡萄胎患者上并且其母亲活着兄妹也存在该基因的突变,另外父亲也可存在NLRP7基因的突变,但是其生育结局不受影响,说明男性NALP7 基因突变可不改变生育结局[14]。
NLRP7 基因突变可在双亲来源完全性葡萄胎,二倍体的父系来源的完全性葡萄胎,三倍体的部分性葡萄胎及四倍体胚胎患者中出现[10]。NLRP7 基因突变者导致合子后分裂异常,以致缺乏胚胎的发育或者胚胎发育异常。目前,基于大量的不同变异以及少数的葡萄胎妊娠,还不能在不同的变异和生殖结果之间识别特殊的相关性。NLRP7的变异是如何导致葡萄胎的发生的机制尚不明确。
2.3 NLRP7与葡萄胎发生的可能联系
NLRP7作为NLRP家族的一员,与先天免疫也存在一定联系,唯一一个体外研究中发现NLPR7基因与细胞生成IL-1β及Caspase-1前体的加工有关;Caspase-1又称ICE,为IL-1β转化酶,可以将IL-1β前体剪切称为为成熟的IL-1β,与真核细胞凋亡和细胞因子的成熟相关,并且参与细胞的生长和分化及抗感染过程;IL-1β又称淋巴细胞激活因子,由单核细胞、巨噬细胞、中性粒细胞等细胞分泌,IL-1β具有激活免疫和炎症通路的细胞因子,在着床前后的子宫含量丰富,有利于着床,控制滋养细胞侵入子宫内膜的深度 ,清除由细菌产生的致多糖(LPS)等对胚胎的毒害作用[2]。
NLPR7基因抑制IL-1β及Caspase-1前体的加工,并且具有抑制Cspase-1依赖性的IL-1β的分泌作用;革兰氏阴性菌细胞壁成分脂多糖(LPS)可以刺激细胞产生IL-1β(10ng/ml LPS可使单核细胞合成IL-1β增加100倍),同时可以增加外周血单个核细胞的NLRP7基因表达;NLRP7基因表达增强可以反馈调节抑制IL-1β的分泌,因此NLRP7可以抑制LPS诱导的IL-1β的分泌[8]。 NLRP7基因的突变导致NLRP7蛋白高度表达,抑制IL-1β及Caspase-1前体的加工,导致Caspase-1依赖的IL-1β不能加工成熟分泌到细胞外,各种炎性细胞得不到IL-1β的刺激而不能及时清除各种病原体对胚囊的毒性,可能是促进滋养细胞增生,胚胎不能正常生成从而导致葡萄胎的一个原因[2]。
NLRP7还被认为是属于CATERPILIER蛋白家族的亚族,而CATERPILIER蛋白家族被认为与凋亡和感染相关[9,10]。有研究表明葡萄胎的产生伴随着炎症细胞在胎盘及植入点的数量的增加[11,12],从一方面说明葡萄胎的产生于炎症途径有着一定的联系。
目前NALP7基因被视为一个炎症途径参与RHM的发生,具体机制尚不明确。有研究发现存在复发性葡萄胎(RHMs)的患者存在NLRP7的变异以及其他免疫系统方面的疾病[10] 。虽然没有明确的研究表明葡萄胎的产生与NLRP7变异导致的免疫缺陷有直接的联系,但是葡萄胎患者特别是复发性葡萄胎患者春在NLRP7的变异是确定的。
3.今后的发展方向
葡萄胎的生育结局很不理想,尤其是复发性葡萄胎的患者。NLRP7的功能以及它的变异与FRHM发生的关系,给我们研究NLRP7与葡萄胎的关系有了新的方向。
复发性葡萄胎的发生于母系NLRP7基因的变异有不可分割的联系,而基因突变的存在对葡萄胎特别是复发性葡萄胎患者的生育结局是一个不良的信号,同时也为今后的治疗做出了尝试的方向,引导出临床对该疾病的新治疗,并且对葡萄胎后能够正常生育做出相应的对策。
- 上一篇:认识葡萄胎(2)---葡萄胎清宫后如何就诊?
- 下一篇:葡萄胎科普知识
- 本文延伸阅读
相关文章
- 葡萄胎能传染吗?
- 葡萄胎会传染给别人吗?
- 得了葡萄胎会传染吗?
- 葡萄胎有传染性吗?
- 葡萄胎会不会传染?
- 葡萄胎传染吗?
- 葡萄胎,肿瘤还是怪胎?(发表于《家庭医生》)
- 微卫星序列多态性检测用于鉴别完全性葡萄胎亲代来源的研究
- 葡萄胎
- 认识葡萄胎(4)---葡萄胎患者清宫前应注意什么?
- 认识葡萄胎(4)---葡萄胎患者清宫前应注意什么?
- 认识葡萄胎(1)---什么是葡萄胎
- 热门阅读
- 热点排行
- 葡萄胎会导致生育受阻吗?
- 葡萄胎患者的饮食护理
- 葡萄胎和哪些疾病鉴别诊断
- 葡萄胎患者两年内不宜妊娠
- 葡萄胎的九大临床体征什么呢?
- 得了葡萄胎怎么办?
- 得了葡萄胎该如何做好护理?
- 葡萄胎的治疗提示详细介绍
免费提问