缺血性脑卒中药物预防的新理念
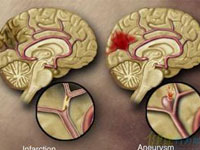
缺血性脑卒中发病率和死亡率均很高,存活者往往残留肢体瘫痪和失语等症状,给患者、家庭和社会造成沉重的负担,因而长期以来一直是研究的重点。以往对缺血性卒中注重于治疗,对其危险因素的防治关注较少。然而,实际上缺血性卒中是最可预防的严重疾病之一,积极的预防往往可获得事半功倍的效果[1]。近年来,随着对缺血性卒中发病机制及药物预防研究的不断深入,其预防性治疗已取得令人瞩目的进展。上海市浦东新区浦南医院神经内科王宇卉
1 抗血小板治疗 动脉粥样硬化是缺血性卒中最重要的危险因素之一,动脉粥样硬化斑块早于20~30岁时即可形成。在炎症和高血压等因素的影响下,血管内皮受损,表达血管细胞粘附分子,促使白细胞(单核细胞和T淋巴细胞)迁移至受损内皮并进入内膜,启动并保持局部炎症反应。单核细胞转化为巨噬细胞后吸收脂质成为泡沫细胞;T淋巴细胞表达炎性细胞因子,促使巨噬细胞、内皮细胞及平滑肌细胞增殖,在血小板和纤维蛋白的参与下,最终形成粥样斑,导致血管管径变细,血流受阻。但实际上血管狭窄70%以上才会出现症状,而动脉粥样硬化斑块的急性破裂是脑血管事件和死亡的主要原因[2]。
阿司匹林(ASA)是目前缺血性卒中一级与二级预防的主要药物,其作用机制是不可逆地抑制血小板环氧合酶的活性,从而阻止血栓烷A2的形成。ASA口服后15~20min血浓度即达高峰,40~60min血小板抑制效应达到最大,小剂量(50mg/d)与大剂量(1500mg/d)的效能似无差异,美国FDA推荐的剂量为50~325 mg/d[3]。ASA作为一级预防药物,可降低缺血性卒中高危患者的发病,但可能增加颅内、外出血的危险;卒中后48h内应用ASA能预防复发,从而达到二级预防目的。根据meta分析结果,ASA可使动脉疾病患者的重大血管事件总体减少19%,缺血性脑卒中减少13%,其差异可能因病理生理学机制不同所致[4]。有人认为部分患者对阿司匹林无反应是由于COX-1基因变异的结果[5]。阿司匹林治疗期间若出现短暂性脑缺血发作(TIA),不能简单地换用另一种抗血小板药就了事,而须重新考虑诊断并检查有无动脉-动脉栓塞外的其他原因,血小板在完全乙酰化后仍有可能通过COX-1抑制外的其他途径聚集[4]。
已证实ASA联合应用双嘧哒莫(潘生丁)后卒中复发风险的降低更明显[3]。双嘧哒莫通过增加环磷酸腺苷和环磷酸鸟苷水平而抑制血小板聚集,但由于其可引起冠脉血管扩张,导致到达非狭窄的冠状动脉的血流量增加,结果在运动期间可能诱发心肌缺血[2];但应用缓释剂型双嘧哒莫并不增加冠状动脉疾病患者的心脏事件[6]。缓释双嘧哒莫/阿司匹林复合制剂(Aggrenox 25/200 mg Bid)1999年获美国FDA批准,可有效减少非致死性卒中,但不能减少心肌梗死或致死性卒中[4]。在欧洲卒中预防研究Ⅱ中,Aggrenox使卒中复发较单用阿司匹林减少19%,较安慰剂减少37%[6]。
噻吩并吡啶类(thienopyridines)阻断二磷酸腺苷介导的血小板聚集[7]。其中噻氯匹啶(ticlopidine)首先用于卒中预防,口服后80%~90%被吸收,1~3h血浆浓度达高峰[3]。在TIA或轻度卒中的噻氯匹啶/阿司匹林卒中研究(TASS)中,用药3年末噻氯匹啶组的卒中发生率较阿司匹林组减少21%,但由于噻氯匹啶有严重的副作用,包括腹泻、皮疹以及严重的血液学副作用如中性粒细胞缺乏、再生障碍性贫血、各类血细胞减少症、红白血病和血栓性血小板减少性紫癜(TTP)等,从而限制了其临床应用,实际上已被摒弃[1]。
氯吡格雷(clopidogrel)是第二代噻吩并吡啶类药物,作用机制与噻氯匹啶相似,在4h内减少ADP介导的血小板聚集,但无明显中性粒细胞减少或出血等副作用;对卒中的预防效应与ASA相似[3]。但近来有报道11例用氯吡格雷后出现TTP,多数在用药14d内发生,部分病例并用其他药物,其中5例用他汀类,3例用阿替洛尔,1例用环胞素A。急性冠状动脉综合征的CURE试验提示,氯吡格雷与阿司匹林合用效果明显,但出血危险增加。目前尚无卒中患者合用阿司匹林或氯吡格雷的证据;正在进行的MATCH试验旨在比较氯吡格雷单用及合用阿司匹林在卒中二级预防中的作用[4]。
近年随着新的抗血小板药物不断问世,可选择的药物愈来愈多,以至于以往所关注的“阿司匹林二级预防的最佳剂量是多少”已被“最佳的二级预防抗血小板药是什么”所取代。然而,迄今这两个问题均无明确的答案[3]。除噻氯匹啶和氯吡格雷属于同一类药外,其他各种抗血小板药的作用机制各异,因而从理论上说,联合治疗比单一治疗获益更大,但有待进一步证实。广为引用的美国心胸医师协会指南将ASA、氯吡格雷或阿司匹林/双嘧哒莫均推荐为卒中二级预防的一线选择;认为阿司匹林/双嘧哒莫“可能”比ASA更有效而副作用相似;联用ASA和氯吡格雷预防卒中的效果仍有待确认[7]。
对美国印第安那大学医院卒中二级预防抗血小板药处方的分析表明,ASA是脑血管病二级预防的一线药物;噻氯匹啶和氯吡格雷常用于“ASA失败”的二线治疗;而新药缓释双嘧哒莫/ASA尚未得以广泛应用,该药除复发性脑血管事件外似无其他效应[3]。
2 抗凝治疗 约20%的缺血性卒中患者由心源性栓塞引起,其中大多因心房纤颤(AF)的附壁血栓所致[2]。AF诱发左心房血栓形成,使卒中的危险增加6倍,并可能随人群持续老龄化而更为增加。抗凝治疗是预防AF患者卒中的主要手段[8]。
抗凝剂主要有肝素和华法令。尽管肝素在短期内降低缺血性卒中的复发,但可显著增加出血性卒中,因而不主张应用;ASA和调适剂量的华法令可有效降低AF患者的卒中风险[9]。华法令是一种维生素K拮抗剂,通过阻止凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ的维生素K依赖性激活而产生抗凝血作用。长期华法令治疗可使国际标准化率(international normalized ratio,INR)达到2.0以上,不仅降低卒中的风险,还降低其临床严重程度及死亡风险[10]。其疗效优于ASA,但引起颅内、外出血危险是阿司匹林的2倍,有出血病史、老年以及具有编码肝微粒体酶CYP2C9和Ⅸ因子前肽的基因多态性者危险更大[11]。一项研究表明,低强度抗凝联合ASA治疗后缺血性卒中或系统性栓塞的年度危险高于充分抗凝者,而严重出血并发症却无明显减少。华法令的出血副作用部分归咎于其治疗窗狭窄以及与其他多种药物和食物的相互作用,因而应用时需常规监测凝血指标并随时调整剂量。华法令起效慢,药效消除也缓慢,并有致畸的危险。因而,适合华法令治疗的AF患者实际上能接受治疗者不足一半。然而,用华法令预防缺血性卒中与治疗卒中相比花费要少。有人建议,约有1/3的AF者为低危人群,应接受阿司匹林治疗;约1/3为高危人群,在安全前提下应用华法令治疗;中度危险人群应接受抗凝监测[12]。
安置机械心脏瓣膜的患者血栓栓塞性卒中的风险很高,需要根据瓣膜类型决定抗凝治疗。如果在进行足量华法令抗凝治疗使INR达到3.0的情况下仍发生系统性栓塞,应加用ASA 80~100mg/d。生物瓣膜的患者仅在瓣膜植入后头3月需要抗凝治疗,此后,单用ASA即可。急性前壁心梗后,特别是合并严重左心功能障碍时,建议抗凝治疗1~3个月。存在有厚度4mm以上的大动脉粥样斑时卒中的风险增加3~9倍,若粥样斑活动或非钙化时则风险进一步增大,有限的证据提示在这种情况下抗凝治疗预防栓塞优于抗血小板治疗[2]。卵圆孔未闭(PFO)可能通过自右至左分流反常栓塞而增加缺血性卒中的风险,一项meta分析表明,抗凝治疗对于PFO患者的卒中二级预防优于抗血小板治疗。对于非心源性卒中,华法令(目标INR 1.4~2.8)与ASA在降低复发风险上无差异,且颅内出血危险增加[2]。
希美拉加群(ximelagatran)是Astra-Zeneca公司开发的一种口服的凝血酶直接抑制剂,为美加拉群(melagatran)的前体药物[13]。其口服后快速从肠道吸收,转化为其活性形式美加拉群而起效。后者在口服后1.6~1.9h浓度达峰,在体内不被代谢,也不与血浆蛋白结合,主要由肾脏清除(约80%),半衰期为4~5h。因此该药每日需要服用2次[11]。常用剂量为36mg,bid,资料表明60mg,bid时,仍能较好耐受[14]。
希美拉加群起效快,药效不受患者年龄、性别、体重、种族或食物摄入的影响,其药物动力学特性可预测而不需调整剂量(除了肾功能不全患者需要减小剂量或延长用药间期),也不需监测凝血指标,因而其适应证较华法令宽[11]。该药可减少AF患者的卒中风险,近来希美拉加群预防非瓣膜性AF患者卒中发作(SPORTIF)Ⅲ期临床试验结果证实,该药预防AF-相关卒中的效果不逊于华法令,且出血并发症少[15]。希美拉加群的缺点是少数(6%)患者出现肝酶活性增高,但通常为时短暂,因此在治疗开始6月内需监测肝功能;由于希美拉加群主要经肾脏清除,故用药期间需测定肾功能。此外,该药较华法令昂贵是其不足。希美拉加群最适合于不能用华法令的高危AF患者,如老年(>80岁)、有出血史以及已知有编码肝脏微粒体酶CYP2C9基因多态性和Ⅸ因子前肽ALA-10突变的患者[11]。
3 抗高血压治疗 已知卒中的危险与日常收缩压(SBP)和舒张压(DBP)的水平增高明显相关,舒张压每升高7.5 mmHg,卒中危险增倍[16];舒张压降低5mmHg,卒中危险减少1/3[17];而孤立的收缩期高血压危险更高,尤其是对于中年男性,其卒中风险几乎增高5倍[2]。控制血压是目前卒中预防研究最活跃的领域,对一些噻嗪类利尿药和β-阻断剂进行的大型一级预防试验的meta分析结果证实,5年间舒张压降低5~6 mmHg者初次卒中发生的相对风险减少38%。抗高血压治疗可以预防有过TIA或卒中患者的血管事件,预防作用与血压下降的幅度呈正相关[17]。许多高血压治疗指南均强调,以往有过脑血管事件和有糖尿病或其他血管疾病者的目标血压应分别低于140/90 mmHg和130/85 mmHg。
噻嗪类利尿剂、血管紧张素转换酶(ACE)抑制剂、血管紧张素受体阻断剂(ARB)和β-阻断剂均可用于卒中预防。尽管恢复正常血压仍是预防卒中的关键所在,对ACE抑制剂或ARBs进行的HOPE研究证实,随血压下降卒中发生率的降低很有限[18]。已知血管紧张素Ⅱ增加VCAM-1表达和炎性细胞因子产生,从而促进动脉粥样硬化形成,因此,对血管紧张素Ⅱ的抑制除能降低血压外,可能还具有防止血管粥样斑形成的保护作用,但尚未得到证实。LIFE试验提示,ARBs预防卒中优于β阻断剂[19]。PROGRESS试验提示,ACE抑制剂与噻嗪类利尿剂联合治疗可能较单用ACE抑制剂更好[20]。ALLHAT试验则发现钙通道阻断剂氨氯地平(amlodipine)、ACE抑制剂赖诺普利(lisinopril)、β阻断剂doxazocin与噻嗪类利尿剂氯噻酮(chlorthalidone)均可预防卒中,氯噻酮组的卒中发生率较赖诺普利有更低趋势,机制不明[21]。有认为除非低血压或有其他治疗禁忌症,所有卒中患者应进行抗高血压治疗,可选用一种ACE抑制剂或ARB与利尿剂[1]。
目前普遍接受噻嗪类和ACE抑制剂均可作为高血压的一线治疗药物,但具体选择哪一种仍未定论。有些研究倾向于噻嗪类,有些则倾向于ACE抑制剂,而另一些则发现两者无差异。临床上多数患者需要一种以上的抗高血压药才能达到正常血压,因而使选择余地增大[2]。一般而言,无其他严重并发症的高血压患者适合用利尿剂或β阻断剂治疗;充血性心力衰竭危险高者及糖尿病患者应用ACE抑制剂;冠心病风险险很低(无其他危险因素和家族史)的患者使用钙拮抗剂即可[22]。
4 降脂治疗 由于高脂血症与卒中的相关性不像其与心肌梗死一样密切,胆固醇作为卒中危险因素长期以来未被重视。但日趋增多的证据表明,用于治疗高脂血症的药物,特别是3-羟基-3-甲基戊二醛-辅酶A(HMG-CoA)还原酶抑制剂(他汀类)具有血管事件保护作用[1,2]。
他汀类通过抑制肝脏和其他组织的胆固醇合成限速酶――HMG-CoA还原酶而降低肝细胞胆固醇含量,增加低密度脂蛋白(LDL)胆固醇受体的表达,通常使LDL胆固醇降低25%~50%。他汀类还降低胆固醇生物合成途径中间产物衍生的类异戊二烯水平。这些中间产物如焦磷酸法呢酯(farnesylpyrophosphate)作为包括异三聚体G蛋白和Ras、Rho等小G蛋白在内的多种蛋白质翻译后修饰的脂质连接分子,在细胞生长、信号转导以及丝裂途径中起重要作用。他汀类可通过一系列机制预防卒中:调节脑内大动脉和颈动脉的血栓形成,因而防止斑块破裂和动脉-动脉血栓栓塞(斑块稳定作用);通过直接上调脑内皮NO合酶(NOS)、增加NO的生物利用度而改善内皮稳态,减少自由基,缩小脑梗死体积并改善神经功能;其可能的抗炎作用也可能产生神经保护和卒中预防作用;此外他汀类还有抗血小板聚集的效应[23]。
Meta分析表明,他汀类显著减少缺血性脑卒中且不增加出血性卒中的危险[2],近年心脏保护研究(HPS)更进一步降低了高危人群降脂治疗的界限,证实无论年龄、性别和其他治疗如何,基础LDL降低至2.5 mmol/L可显著降低所有的血管事件[24]。尽管他汀类的临床获益很大程度上取决于降低LDL胆固醇,越来越多的资料表明其多效作用是类异戊二烯耗竭的结果。有资料提示,他汀类除降低卒中危险外,还可能减少痴呆的发生。降胆固醇无疑应作为卒中预防的一部分。在美国国家胆固醇教育计划(NCEP)2001年发表的成人治疗纲要第3版(ATP III)中,指令对冠状动脉或周围血管疾病以及糖尿病患者强力降胆固醇治疗;症状性颈动脉疾病也是降胆固醇的指征;尚无冠状动脉疾病或周围血管病证据的卒中和TIA患者没有他汀类治疗的明确适应证[25]。一项非他汀类干预的meta分析表明,用贝特类药物、烟酸(niacin)和控制饮食使总胆固醇降低至6 mmol/L以下能降低卒中的风险,但贝特类与他汀类合用的安全性与效果尚不清楚[2]。
结论
综上所述,目前脑卒中治疗的概念已不再局限于发病后的急救处理,预防性治疗,尤其是适当应用预防性药物以减少卒中发病的观点逐渐引起重视。总体上,为避免发生脑卒中,有高血压等脑卒中危险因素者应积极进行相应的一级预防治疗,TIA是卒中二级预防的黄金时机,已患TIA或脑卒中者则应进行二级预防治疗[26]。由于卒中预防性药物种类繁多,机制不一,价格相差也很大,应因人而宜,选择合适的药物。一般而言,ASA仍然是动脉粥样硬化性卒中首次发作后二级预防的一线治疗;对ASA不能耐受患者推荐用氯吡格雷。心房纤颤和人工心瓣膜患者应用华法令进行抗凝治疗。噻嗪类或ACE抑制剂都可作为抗高血压的一线治疗药物。所有患过TIA、缺血性卒中或有HPS所确立的血管病高危因素的患者,不管其血清胆固醇水平如何,都应该用他汀类治疗[2]。
- 上一篇:脑梗塞或脑供血不足预防用药、治疗的相关知识
- 下一篇:长期服避孕药易患脑梗塞?
- 本文延伸阅读
相关文章
- 脑梗塞患者需科学用药
- 脑梗塞中药运用
- 脑梗塞爱小便吃什么药
- 得了脑梗塞怎么用药
- 脑梗塞吃什么药
- 脑梗塞患者的科学用药
- 脑梗塞用什么药好
- 治疗脑梗塞的药物
- 脑梗塞吃什么药
- 脑梗塞的治疗药物
- 治脑梗塞有效的药
- 治脑梗塞的中药
- 热点排行
- 脑梗早期降血压要慎重
- 治疗脑梗塞的有效方法介绍
- 脑梗塞为什么总在清晨发作?
- 脑梗塞的急救措施是什么?
- 脑梗塞易发的主要原因是什么
- 脑梗塞病人的症状表现是什么
- 脑梗塞的后遗症有哪些症状
- 脑梗塞的治疗方法是什么?
免费提问