心力衰竭非药物治疗的进展
时间: 2009-05-05 13:49:00 作者:郭继鸿
心力衰竭(简称心衰)常是器质性心脏病的晚期表现。美国每年新发生的心衰患者达40万,而中国远远超过这一数字。这些患者的生活能力都受到极大限制,很多已成为功能性残疾人。近60年来,对心衰的病理、生理、发病机制等方面进行了广泛而深入的研究,新的治疗方法不断涌现和发展。河南中医学院第一附属医院心内科麻京豫
近年来,冠心病、卒中、高血压病、风湿性心脏病等心血管疾病的死亡率正在下降,与之相反,心衰的死亡率却稳步增高。心血管疾病的发病率及死亡率明显下降,而心衰的死亡率反而增高的原因与下列因素有关:(1)社会人群和心血管疾病患者群的老龄化;(2)心血管疾病治疗技术的显著进步,先进而更为有效的治疗使心血管疾病的患者得以存活,数年后心功能恶化,发生心衰。
在发达国家的老年患者,心衰的发病率高达10%。在纽约心脏病协会(NYHA)心功能分级Ⅲ~Ⅳ级的患者,年死亡率高达30%~40%。恶性肿瘤中,恶性黑色素瘤和小细胞肺癌的预后最差,而心衰的预后仅次于黑色素瘤和小细胞肺癌,比其他的癌症预后更差。Framingham的资料表明,严重心衰患者的五年死亡率男性为75%,平均存活3.2年;女性患者的五年死亡率为62%,平均存活5.4年。正如美国心脏病学家Braunwald所说,心衰是21世纪最重要的心血管病症,是心脏病领域最大的一个战场。
心衰的药物及非药物治疗近50年来已有长足的进展,如果把心衰比作一匹已经患病的马拉着一辆货车上山,则临床治疗有以下几种方法:(1)车夫把鞭子抽得更响,让马跑得更快,如同内科医生给心衰患者服用了洋地黄;(2)把车上的货物卸掉一些,减少病马的负担,就像医生给患者服了利尿剂、ACEI等药物;(3)车夫让有病的马走得慢一些,就像给心衰的患者服用了β受体阻滞剂。利尿剂、ACEI和β受体阻滞剂目前是心衰治疗的新三联药物,而洋地黄类药物是其第四类治疗药物;(4)把病态的马换上一匹健康的马,即外科医生给心衰患者进行心脏移植;(5)把病态马换成一部拖拉机继续拉车向前走,即外科医生给心衰患者移植一个全人工心脏。目前心衰患者已经获得十分满意的理想化治疗。本文重点介绍顽固性心衰的8种非药物治疗。
一、全人工心脏
全人工心脏是人工制作的一种精密装置,该装置和心脏一样,能够满足和支持人体的肺循环和体循环。这种全人工制作的装置,结构精密、控制系统完备,完全能达到一般心脏的等同功能,满足机体的生理需要。目前世界上已有多种人工心脏,而临床应用最多的是气动式人工心脏,这种人工心脏有一个硬的外壳,内有几个柔软的血囊,其由一个驱动器产生的气体压力周期性地挤压血囊,产生周期性收缩与舒张。1990年,美国FDA正式批准了这种气动式全人工心脏的临床应用,最早应用Javik-7-100型人工心脏,多数用于等待心脏移植的过渡患者,第一例植入术于1982年12月2日完成,患者名为B.Clark,这一事件震动了全世界,这家医院每天都向全世界通报B.Clark的健康状况,植入112 d时,B.Clark因多器官衰竭死亡,死亡的直接原因是呼吸道感染、低血压和心衰。死亡时,Javik-7-100型人工心脏的功能仍然正常。
继Javik-7-100型人工心脏之后,更为先进的AbioCor永久型人工心脏问世。AbioCor人工心脏2001年进入临床应用,与Javik-7-100型人工心脏相比,AbioCor人工心脏的特点是把人工心脏需要的驱动器和电源完全植入体内。此外,体内还要植入经无线充电技术的充电器装置。因此,AbioCor型人工心脏除内置式锂电池供电外,还有外置式的电池通过无线充电技术给体内的电池充电。所以,移植后的患者不再有任何导线与体外相通,患者活动的自由度因此可以加大,可以游泳、洗澡,生活质量可以得到极大地提高。但其也有一定的缺点:体积偏大,费用昂贵。在将来,外科医生完全能够根据患者的选择而实施治疗,这是一个为时不远的外科治疗模式。
除气动式全人工心脏外,还有一种电动式的全人工心脏,现在这种电动式全人工心脏已经完成了动物实验,进入了实验和临床应用阶段。
二、心脏移植
心脏移植是把因其他原因已经死亡人体的心脏移植到心衰患者的体内。这一治疗技术于1967年2月由南非的医生在南非首都开普敦开创并成功完成首例手术。虽然这位57岁的患者在移植术后仅活了18 d,死于肺部感染,但是巴纳德医生的这一创举开创了心衰非药物治疗的新纪元,并对心衰终末期的概念提出了挑战。1968年,全世界17个国家60多个医疗中心为102例心衰患者进行了心脏移植手术,但绝大多数患者都因排斥反应或术后感染而在短期内死亡。鉴于这点,很多中心在很长时间内都停止了心脏移植手术。直到20世纪80年代,由于抗机体排斥反应十分有效的环孢素问世,再加上心脏外科手术技术的进步、心肌保护技术的改进等,心脏移植术临床应用逐渐增多。时至今日,全球已有10万多心衰患者接受了这一治疗,手术的成功率高达95%以上,而术后心衰患者的生活质量和预后的改善非常可观,五年的生存率可达76%以上。心脏移植的患者最长已经存活了30余年,有的患者术后甚至还能参加马拉松比赛。
心脏移植术的适应证是药物和其他治疗方法无法控制的晚期心衰患者。但是,确定哪些患者属于终末期心衰的客观指标临床尚难于界定,多数学者认为,临床估计心衰患者的生存时间不能维持1年时,属于心衰的终末期;还有的学者认为,心衰患者的左心室射血分数值低于25%,肺楔压高于25 mm Hg的患者,属于终末期心衰。
心脏移植术分为原位移植和异位移植两种:(1)原位心脏移植:将心衰患者衰竭的心脏切除,并在原位移植同种异体者的供体心脏,这种移植方法占心脏移植的99%。手术过程相对简单。手术时结扎上下腔静脉,把病态的心脏切下来,但切下来的不是整个心脏,而是部分上腔静脉、下腔静脉、心房及全部心室。留下右心房和左心房后半部的原因是右房连接着上腔和下腔静脉,左心房连接着4个肺静脉。因此,将供体心脏与残留的原心脏和大血管做端端吻合后,原位心脏移植的外科手术就已完成。(2)异位心脏移植:移植术中不切除心衰患者的病态心脏,只是将供体心脏做并列缝合。移植后,心衰患者的胸腔内将有两个并列存在的心脏,各自按照自己的心律收缩和舒张。异位心脏移植手术更为复杂,并发症更多,因此,其仅占心脏移植术的1%,主要适用于心衰患者已有肺动脉高压,或者心衰者的身材高、体重大,而供心者矮小时,心脏移植术后的心脏仍不能满足患者机体的需要,而又找不到合适的心脏供体时才考虑实行异位心脏移植。异位心脏移植的优点是一旦患者术后发生排斥反应时,被排斥的移植的心脏可以摘除,原来自己的心脏仍可维持循环等待再次心脏移植。
近几年,国内越来越多的医院已开展这一手术,手术的成功率高达80%以上,术后一年的生存率达90%以上,国内心脏移植患者的最长存活时间已到11年。
为防止排斥反应,人工心脏移植术后的患者需要终生服用免疫抑制剂,常是环孢素、皮质醇等药物的联合应用。这些免疫抑制剂的药费昂贵,对术后患者也是一个沉重的负担,这是目前心脏移植面临的一个困难问题。
三、左心室辅助装置
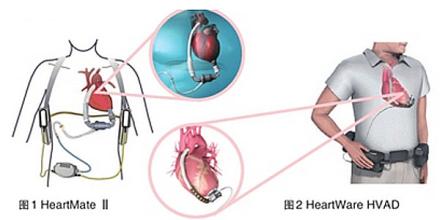
心脏是体内循环的中枢,而左心室是心脏最重要的核心部分,左心室的工作重要,但形式简单,其工作就是依靠心室的收缩和舒张,把压力低的静脉回流血,打到压力高的动脉之中去,这就是心室重要而简单的工作,类似平常应用的升压泵。心室的这种升压功能完全可以用人工泵替代,先把静脉压力低的血流引入人工升压泵内,升压泵升压后再打到动脉中去,替代这一功能的装置称为心室辅助装置。左心室辅助装置是把左心房的血流引出,经过升压泵打到主动脉内;右室辅助装置是把压力低的右房血流引出,经升压泵打到肺动脉内。
心室辅助装置主要用于以下情况:(1)心胸外科术后心功能不稳定时,用心室辅助装置进行一定时间的辅助循环;(2)慢性心衰患者准备做心脏移植,等待供心的过渡期;(3)心肌梗死的面积比较大,循环状态不稳定时,临时应用心脏辅助装置。近年来,心脏辅助装置的应用范围不断扩大,前述的几种情况可视为临时性心室辅助装置,目前,慢性心衰的病例已开始应用永久性心室辅助装置,与全人工心脏相比,其结构及功能简单,造价低,并发症少。
心室辅助装置治疗的心衰患者一至两年的存活率非常高,患者的心功能都能得到不同程度的恢复。心室辅助装置治疗心衰时也有一定的并发症和感染率,血栓栓塞发生率。心室辅助装置因其耗电量较大需要较大的能源,人工升压泵通过导线与植入体内的蓄电池连接,同时还与体外另一组电池组相连,因此,心室辅助装置由两个电池组供电,更大的电池组常在体外,为此,患者常需要背着一个比较大的体外电池组保证能源供给。
目前,其心室辅助装置的能源有两点改进:(1)电池变成了高能供电电池,优点是电池为高能、体积变小,而且高能电池可以完全植入患者的腹部;(2)无线充电技术的提高,使体内的电池可通过体外装置进行无线充电。如同人工心脏一样,它使患者在较长时间不需要体外能源给完全植入人体的心室辅助装置供给能源。如果体内植入的电池可以连续应用两年,两年后再更换电池,这样心室辅助装置就变成了“永久性”心脏辅助装置。因此,心室辅助装置治疗心衰非常有前途。
四、背阔肌心肌成形术
背阔肌心肌成形术是将心衰患者的背阔肌游离出来,即原来供血血管和支配神经不隔断,一起与背阔肌被分离。随后,背阔肌通过左侧肋间进入胸腔,把衰竭的心脏包裹,使患者自己的背阔肌帮助已衰竭的心脏工作。治疗心衰的机制:(1)背阔肌的收缩可以帮助心脏收缩;(2)背阔肌缝在心脏的外面,防止心脏过度舒张;(3)背阔肌包裹心脏后有很多新生血管和新的血液供应。上述三点是背阔肌成形术治疗心衰的三个重要机制。
这项治疗技术有两个技术难点:第一,背阔肌和心肌不同,背阔肌是普通的骨骼肌,有易疲劳性,例如连续上了几层楼、走了几里路、爬了几座山,人就会感到腰酸腿痛,因为这些骨骼肌疲劳了,需要休息,这就是骨骼肌(背阔肌)的易疲劳性。而心肌具有耐疲劳特点,从胚胎到出生再到最后死亡,心肌一刻不停地跳动,因为心肌有耐疲劳性。如果心肌成形术后背阔肌包裹在心脏的外面,跳了几个小时后疲劳了,甚至需要休息,可以想象,这么大的一块肌肉包裹在心脏的外面,疲劳后心肌收缩的时候不仅自己收缩,还要带动背阔肌收缩,结果肯定事与愿违。因此在术前要对背阔肌进行训练,改掉易疲劳性,变成和心肌一样有耐疲劳性。第二个难点是背阔肌包裹在心脏外面,看起来容易同步收缩和舒张。但是,背阔肌并不知道心脏什么时候收缩、什么时候舒张。因此,两者同步性的难题必须解决。解决的方法就是依靠中间介导的感知和刺激装置,该装置可以感知心脏的电活动和机械收缩,然后立即发出电刺激,刺激背阔肌,通过这种方式可以解决背阔肌和心脏同步性的问题。
背阔肌心肌成形术后患者的死亡率明显下降,五年存活率高达60%,目前最长的患者已存活了很多年。国内只做过几例这种手术,主要问题是中介的感知和刺激装置的价格非常昂贵。
- 上一篇:β受体阻滞剂适应症选择误区
- 下一篇:老年高血压相关舒张心力衰竭药物治疗选择
相关文章
- 一种改善心衰症状的实验性药物
- 心力衰竭治疗药方哪个更好
- 治疗心衰的常用药物如何选择
- 心衰药物治疗的几个注意事项
- 心力衰竭病患的常备救命药品
- 总结能够治疗心力衰竭的药物
- 利尿药物对心力衰竭的不良作用
- 中医药如何调节心力衰竭患者呢
- 心力衰竭病患的常备救命药品是什么
- 慢性心力衰竭的用药有什么原则
- 哪些药物治疗心衰效果好
- 心力衰竭用药适应症及禁忌症
- 热门阅读
- 热点排行
- 心力衰竭治疗方法包括哪几种
- 急性左心衰竭有什么症状
- 充血性心衰有哪些运动方法
- 心力衰竭的家庭护理妙招是什么
- 心力衰竭病患的常备救命药品
- 如何准确诊断心力衰竭呢?
- 贫血可增加心衰患者的死亡风险
- 治疗心衰的药物导致的危害有什么呢
免费提问